La capacité calorifique d'un gaz est la quantité d'énergie qu'un corps absorbe lorsqu'il est chauffé d'un degré. Analysons les principales caractéristiques de cette grandeur physique.

Définitions
La chaleur spécifique d'un gaz est l'unité de masse d'une substance particulière. Ses unités de mesure sont J/(kg·K). La quantité de chaleur absorbée par le corps lors du changement de son état d'agrégation est associée non seulement à l'état initial et final, mais également à la méthode de transition.

Département
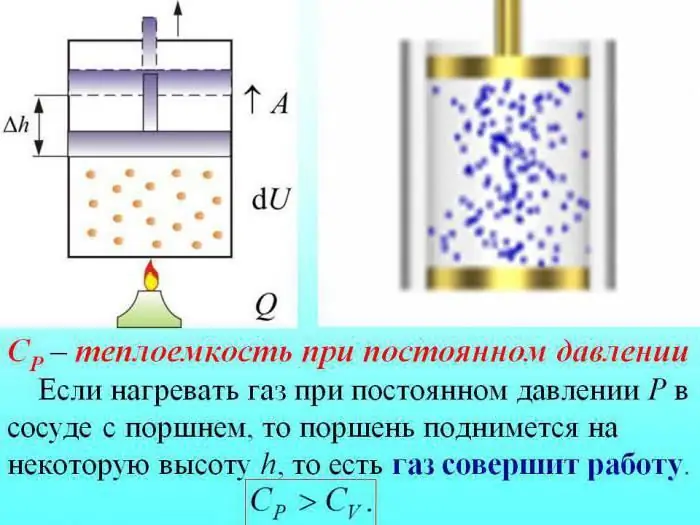
La capacité calorifique des gaz est divisée par la valeur déterminée à volume constant (Cv), pression constante (Cр).
Dans le cas d'un chauffage sans changement de pression, une partie de la chaleur est dépensée pour produire le travail d'expansion du gaz, et une partie de l'énergie est dépensée pour augmenter l'énergie interne.
La capacité calorifique des gaz à pression constante est déterminée par la quantité de chaleur dépensée pour augmenter l'énergie interne.
État du gaz: caractéristiques, description
La capacité calorifique d'un gaz parfait est déterminée en tenant compte du fait que Сp-Сv=R. Cette dernière quantité est appelée la constante universelle des gaz. Sa valeur correspond à 8,314 J/(mol K).
Lorsque vous effectuez des calculs théoriques de capacité calorifique, par exemple en décrivant la relation avec la température, il ne suffit pas d'utiliser uniquement des méthodes thermodynamiques, il est important de vous armer d'éléments de physique statique.
La capacité calorifique des gaz implique le calcul de la valeur moyenne de l'énergie du mouvement de translation de certaines molécules. Un tel mouvement se résume au mouvement de rotation et de translation de la molécule, ainsi qu'aux vibrations internes des atomes.
En physique statique, il existe des informations selon lesquelles pour chaque degré de liberté de mouvement de rotation et de translation, il existe une quantité pour un gaz égale à la moitié de la constante universelle des gaz.

Faits intéressants
Une particule d'un gaz monoatomique est supposée avoir trois degrés de liberté de translation, donc la chaleur spécifique d'un gaz a trois degrés de liberté de translation, deux de rotation et un degré de liberté de vibration. La loi de leur distribution uniforme conduit à assimiler la chaleur spécifique à volume constant à R.
Au cours des expériences, il a été constaté que la capacité calorifique d'un gaz diatomique correspond à la valeur R. Un tel écart entre la théorie et la pratique s'explique par le fait que la capacité calorifique d'un gaz parfait est associée à la valeur quantique effets, par conséquent, lors des calculs, il est important d'utiliser des statistiques basées sur le quantummécanique.
Basé sur les fondements de la mécanique quantique, tout système de particules qui oscillent ou tournent, y compris les molécules de gaz, n'a que quelques valeurs discrètes d'énergie.
Si l'énergie du mouvement thermique dans le système n'est pas suffisante pour exciter des oscillations d'une certaine fréquence, ces mouvements ne contribuent pas à la capacité thermique totale du système.
En conséquence, un certain degré de liberté devient "gelé", il est impossible de lui appliquer la loi d'équipartition.
La capacité calorifique des gaz est une caractéristique importante de l'état dont dépend le fonctionnement de l'ensemble du système thermodynamique.
La température à laquelle la loi d'équipartition peut être appliquée au degré de liberté vibrationnel ou rotationnel est caractérisée par la théorie quantique, relie la constante de Planck à la constante de Boltzmann.

Gaz diatomiques
Les écarts entre les niveaux d'énergie de rotation de ces gaz sont d'un petit nombre de degrés. L'exception est l'hydrogène, dans lequel la valeur de la température est déterminée par des centaines de degrés.
C'est pourquoi la capacité calorifique d'un gaz à pression constante est difficile à décrire par la loi de distribution uniforme. Dans les statistiques quantiques, lors de la détermination de la capacité calorifique, il est pris en compte que sa partie vibrationnelle, dans le cas d'une diminution de la température, diminue rapidement et atteint zéro.
Ce phénomène explique le fait qu'à température ambiante il n'y a pratiquement pas de partie vibrationnelle de la capacité calorifique, pargaz diatomique, il correspond à la constante R.
La capacité calorifique d'un gaz à volume constant dans le cas d'indicateurs à basse température est déterminée à l'aide de statistiques quantiques. Il y a le principe de Nernst, qui s'appelle la troisième loi de la thermodynamique. Sur la base de sa formulation, la capacité thermique molaire d'un gaz diminuera avec la diminution de la température, tendant vers zéro.

Caractéristiques des solides
Si la capacité calorifique d'un mélange de gaz peut être expliquée à l'aide de statistiques quantiques, alors pour un état solide d'agrégation, le mouvement thermique est caractérisé par de légères fluctuations de particules près de la position d'équilibre.
Chaque atome a trois degrés de liberté vibratoire, donc, conformément à la loi d'équipartition, la capacité calorifique molaire d'un solide peut être calculée comme 3nR, n étant le nombre d'atomes dans une molécule.
En pratique, ce nombre est la limite vers laquelle tend la capacité calorifique d'un corps solide à haute température.
Le maximum peut être obtenu à des températures ordinaires pour certains éléments, y compris les métaux. Pour n=1, la loi de Dulong et Petit est satisfaite, mais pour les substances complexes il est assez difficile d'atteindre une telle limite. Comme la limite ne peut pas être atteinte dans la réalité, il se produit une décomposition ou une fusion du solide.
Histoire de la théorie quantique
Les fondateurs de la théorie quantique sont Einstein et Debye au début du XXe siècle. Il est basé sur la quantification des mouvements oscillatoires des atomes dans un certaincristal. Dans le cas des indicateurs à basse température, la capacité calorifique d'un corps solide s'avère être directement proportionnelle à la valeur absolue prise au cube. Cette relation a été appelée la loi de Debye. En tant que critère permettant de distinguer les indicateurs de basse et de haute température, leur comparaison avec la température de Debye est prise.
Cette valeur est déterminée par le spectre des vibrations d'un atome dans le corps, elle dépend donc sérieusement des caractéristiques de sa structure cristalline.
QD est une valeur qui a plusieurs centaines de K, mais, par exemple, elle est beaucoup plus élevée dans le diamant.
Les électrons de conduction contribuent de manière significative à la capacité calorifique des métaux. Pour le calculer, les statistiques quantiques de Fermi sont utilisées. La conductivité électronique des atomes métalliques est directement proportionnelle à la température absolue. Comme il s'agit d'une valeur non significative, elle n'est prise en compte qu'à des températures tendant vers le zéro absolu.
Méthodes de détermination de la capacité calorifique
La principale méthode expérimentale est la calorimétrie. Pour effectuer un calcul théorique de la capacité calorifique, la thermodynamique statistique est utilisée. Elle est valable pour un gaz parfait, ainsi que pour les corps cristallins, est réalisée sur la base de données expérimentales sur la structure de la matière.
Les méthodes empiriques de calcul de la capacité calorifique d'un gaz parfait sont basées sur l'idée de la structure chimique, la contribution de groupes individuels d'atomes à Ср.
Pour les liquides, on utilise également des méthodes basées sur l'utilisation de la thermodynamiquecycles qui permettent de passer de la capacité calorifique d'un gaz parfait à un liquide par la dérivée de la température de l'enthalpie du processus d'évaporation.
Dans le cas d'une solution, le calcul de la capacité calorifique en tant que fonction additive n'est pas autorisé, car la valeur excédentaire de la capacité calorifique de la solution est fondamentalement significative.
Pour l'évaluer, nous avons besoin de la théorie moléculaire-statistique des solutions. Le plus difficile est l'identification de la capacité calorifique des systèmes hétérogènes en analyse thermodynamique.

Conclusion
L'étude de la capacité calorifique vous permet de calculer le bilan énergétique des processus se produisant dans les réacteurs chimiques, ainsi que dans d'autres appareils de production chimique. De plus, cette valeur est nécessaire pour la sélection des types de liquides de refroidissement optimaux.
À l'heure actuelle, la détermination expérimentale de la capacité calorifique des substances pour différents intervalles de température - des valeurs basses aux valeurs élevées - est la principale option pour déterminer les caractéristiques thermodynamiques d'une substance. Lors du calcul de l'entropie et de l'enthalpie d'une substance, des intégrales de capacité thermique sont utilisées. Les informations sur la capacité thermique des réactifs chimiques dans une certaine plage de température vous permettent de calculer l'effet thermique du processus. Les informations sur la capacité calorifique des solutions permettent de calculer leurs paramètres thermodynamiques à n'importe quelle valeur de température dans l'intervalle analysé.
Par exemple, un liquide est caractérisé par la dépense d'une partie de la chaleur pour changer la valeur de l'énergie potentiellemolécules réactives. Cette valeur est appelée capacité calorifique de "configuration", utilisée pour décrire les solutions.
Il est difficile d'effectuer des calculs mathématiques à part entière sans prendre en compte les caractéristiques thermodynamiques d'une substance, son état d'agrégation. C'est pourquoi, pour les liquides, les gaz, les solides, une caractéristique telle que la capacité thermique spécifique est utilisée, ce qui permet de caractériser les paramètres énergétiques d'une substance.






